Органические кислоты - общая формула, характеристика и список соединений
Понятие кислота
В 1877 году химик из Швеции Сванте Аррениус предложил разделять ряд веществ на основания и кислоты. Согласно его теории, если при растворении в воде элемент высвобождает протон водорода Н+, его нужно относить к кислоте, а если гидроксид-иона (ОН-), то к основанию. Это правило позволило объяснить нейтрализацию веществ при взаимодействии друг с другом. Позже учёный дал уточнение, что сталкивание гидроксид-иона с ионом водорода образовывает воду H2O.
В начале двадцатого века британец Томас Лаури и датчанин Йоханнсен Брёнстед расширили определение. Они предложили относить к кислотам любую молекулу (ион), способную отдавать протон. Это позволило описать реакции, проходящие c водой, например, хлорид аммония.
В 1923 году американец Льюис на основании двух определений сформулировал своё правило. Его формулировка и стала использоваться повсеместно. По нему, кислота — это химическое соединение, принимающее электронную пару и образовывающее ковалентную связь. Основание же, напротив — соединение, способное избавляться от электронной пары.
Все кислоты в химии принято разделять на 2 типа:
- Кислородосодержащие;
- Бескислородные.
Кроме этого, соединения могут быть одноосновными, двухосновными или трёхосновными. Все кислоты, за исключением кремниевой, отлично растворяются в воде. При взаимодействии с основаниями образуют соль, воду и кислотный остаток. Протекание реакции при соприкосновении с металлами происходит не всегда. Взаимодействие возможно лишь элементов, которые располагаются левее водорода. При этом кислотное соединение должно быть не только сильным, но и способным отдавать частицы водорода, которые выделяются во время взаимодействия.
Кислотные растворы могут изменять цвет. Так, лакмус становится красным. Соединение при взаимодействии имеет кислый вкус, появляется электрическая проводимость.
Если же в кислотный раствор добавить спирт, образуется сложный эфир. Все приведенные свойства характерны как для органических соединений, так и неорганических.
Особенности органического класса
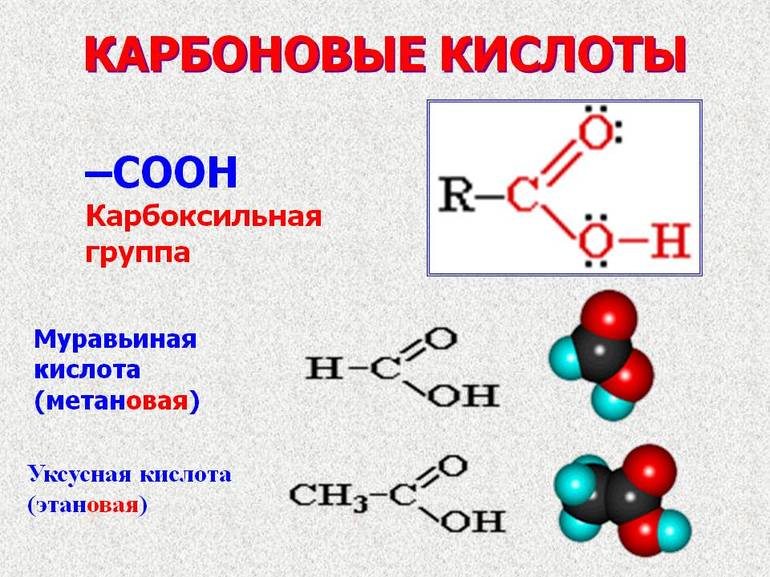
Органическая химия изучает синтезирование углеводородов и их производство. Производные соединения углерода и водорода в молекулах относятся к карбоксильной группе (- COOH). Название веществ состоит из двух элементов: карбонита и гидроксила. Свойства же группы определяется смещением электронной плотности к карбонильному кислороду и образованной поляризацией связи O-H.
Другое название карбонатных кислот — органические. Их свойства определяются строением. Особенности группы из-за диссоциации с образованием частиц водорода в том, что её свойства совпадают с минеральными кислотами. Некоторые соединения, например, уксусная кислота (СН3СОOН) в своей молекуле имеют углеводородный радикал, поэтому возможны реакции, сопровождающиеся выбиванием водорода галогеном. Этот процесс приводит к повышению степени диссоциации, и кислота становится сильнее.
Из свойств органических соединений можно выделить:
- При реагировании с металлами образуется соль и водород — CH3-CH2-COOH + K → CH3-CH2-COO-K + H2.
- Реакция с галогенами описывается формулой: CH3 — CH2 — C = O (-OH) + Cl2 → CH3 — CH (-Cl) — C = O (-OH) + HCl, то есть протекает с появлением галогеносодержащих кислот.
- Взаимодействие со спиртом приводит к возникновению эфира: CH3 — CH2 — COOH + CH3 — OH → CH3 — COOH — CH3.
- При реагировании с металлами образуется соль и вода: CH3-CH2-COOH + MgO →Mg (CH3-CH2-COO)2 + H2O.
- Соединение с солью приводит к слабой кислотности с образованием иной соли: CH3CH2-COO-Na + H2O + CO2.
Так как карбоновые кислоты распадаются на ионы, степень растворимости и достаточно большая температура кипения определяют межмолекулярные водородные связи. При этом с возрастанием молекулярной массы растворимость соединения уменьшается.
Карбоновые кислоты принято разделять и по природе углеводородного радикала: они бывают алифатическими, ароматическими и алициклическими. Если же в первом типе содержится более шести атомов углерода, соединение называют жирной кислотой. Это происходит из-за того, что в виде сложных эфиров они являются частью природных жиров и масел.
Ароматическая представляет собой бензойную и дикарбоновую кислоту, а алициклическая – циклопропан-карбоновую и циклогексанкарбоновую кислоты. Из структуры соединений выделяют радикалы (ацилы). Подписывают их используя суффикс – ил., например, бутрил, формил.
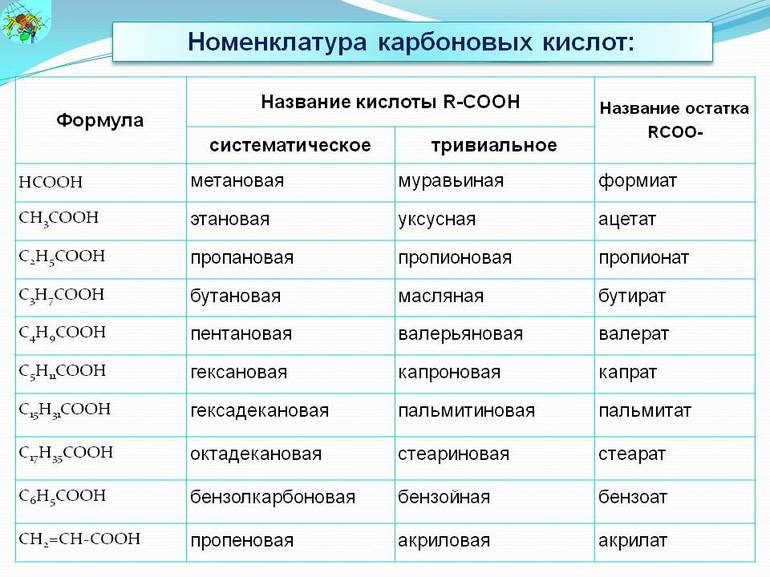
Таблица соединений
Существует две системы обозначений для карбоновых соединений. Их классификация допускает использование тривиального названия и по ИЮПАК. В то же время применение систематической номенклатуры считается более предпочтительной. Всё дело в том, что тривиальные имена не содержат сведений о составе и строении соединений, а некоторые сложные эфиры и соли вовсе не имеют сокращённых наименований.
В мире насчитывается более сотни различных видов органических кислот. Они входят в компоненты природных вод и связаны с жизнедеятельностью человека, животных и растений. Общую формулу для всей группы можно изобразить как R—COOH. Из наиболее популярных соединений можно выделить:
| Тривиальное имя | Название по ИЮПАК | Содержащиеся соли и эфиры | Номер регистрации по CAS |
| Адипиновая | Гександиовая | Адипинаты | 124-04-9 |
| Акриловая | Пропеновая | Акрилаты | 79-10-7 |
| Аспарагин | 4-амид-2-аминобутандиовая | 70-47-3 | |
| Бензиловая | Гидроксидифенилуксусная | 76-93-7 | |
| Валериановая | Пентановая | Валераты | 109-52-4 |
| Ванилиновая | 4-гидрокси-3-метоксибензойная | 121-34-6 | |
| Винная | 2,3-дигидроксибутандиовая | Тартраты | 133-37-9 |
| Виноградная | DL-винная | 526-83-0 | |
| Гистидин | 2-амино-3-(4-имидазолил)пропановая | 351-50-8 | |
| Глицин | Аминоуксусная | 56-40-6 | |
| Изоянтарная | Метилмалоновая | 516-05-2 | |
| Камфорная | цис-1,2,2-триметилциклопентан-1,3-дикарбоновая кислота | 560-09-8 | |
| Кофейная | 3-(3,4-дигидроксифенил)пропеновая | 331-39-5 | |
| Лимонная | 2-гидрокси-1,2,3-пропантрикарбоновая | Цитраты | 77-92-9 |
| Лимонно-яблочная | 2-гидрокси-2-метилбутандиовая | 597-44-4 | |
| Мелиссовая | Триаконтановая | Мелиссаты | 506-50-3 |
| Молочная | 2-гидроксипропановая | Лактаты | 50-21-5 |
| Никотиновая | Пиридин-3-карбоновая | Никотинаты | 59-67-6 |
| Оксаминовая | Моноамид щавелевая | 471-47-6 | |
| Пенициллиновая | (2Z)-3-метокси-5-метил-4-оксо-2,5-гексадиеновая | 90-65-3 | |
| Пробковая | Октандиовая | Субераты | 505-48-6 |
| Салициловая | 2-гидроксибензойная | Салицилаты | 69-72-7 |
| Травматиновая | 2-додецендиовая | 64-02-36-4 | |
| Уксусная | Этановая | Ацетаты | 64-19-7 |
| Фенантровая | 1-фенантренкарбоновая | 27875-89-4 | |
| Фолиевая | 59-30-3 | ||
| Яблочная | Малаты | 6915-15-7 |
Отдельно нужно выделить муравьиную кислоту (HCOOH). Это одноосновное соединение. В природе она вырабатывается у пчёл, муравьёв, содержится в крапиве и хвое. Проявляет восстановительные свойства. Эта кислота очень востребована как антибактериальное средство.
Происхождение и получение
Получение HOOC-соединений связано с окислением спиртов. Протекающую реакцию окисления этилового спирта можно записать как CH3 – CH2 – OH → CH3 – C = O (-OH) + H2O. Окисление же уксусного альдегида выглядит следующим образом: CH3 – C = O (H) → CH3 – C =O (-OH). Образование возможно и гидролизом нитрилов. Побочным продуктом является аммиак: CH3 – C = N + H2O → CH3 – C = O (-OH) + NH3.
Карбоновую кислоту можно создать гидролизом сложного эфира. В результате реакции получается спирт. Что интересно, если в реакции использовать щёлочь, продуктом станет соль. Но если её поместить в минеральную кислоту, получится органическая. Реакция имеет вид: СH3 – C = O (-CH3) + H2O → CH3 – C = O (-OH) – CH3OH. Этот способ применяется для получения высших соединений: пальмитинового ( C 16 H 32 O 2), стеаринового ( c17h35cooh), олеинового ( c17h33cooh). При этом в воде они не растворяются.
Сульфокислоты, описываемые формулой RSO3H с органическим радикалом, по функциям сходны с сульфогруппой -SO3H. Получают их путём сульфирования ароматических углеводов. Например, нуклеофильным обменом иона галогена на сульфогруппу, сульфоокислением алканов, тиолов и органических дисульфидов.
Всего же можно выделить следующие способы:
- окисление;
- гидролиз;
- разложение цианидов;
- использование раствора Гриньяра.
В промышленности предельные монокарбоновые кислоты получают из жиров, восков, масел. Довольно распространённый способ образования соединений - путём окисления алканов и алкенов. Например, муравьиная кислота образовывается из метана 2CH4 + + 3O2 → 2HCOOH + 2H2O, а уксусная из н-бутана 2CH3-CH2-CH2-CH3 + 5O2 → 4CH3COOH + 2H2O. Кроме этого, выполняют окисление алканов, гомологов бензола. Производство возможно и в лабораторных условиях. Так в них выполняют гидролиз сложных эфиров и галогенпроизводных, растворяют ангидриды. Какой способ предпочтителен, зависит от имеющихся реактивов и необходимой концентрации полученного раствора.
Некоторые кислоты можно выделить из живых организмов. Например, муравьиную, уксусную. Если первую выделяют из красных муравьёв, вторая содержится в выделениях животных, образуется в результате брожения или скисания. Бензойная кислота находится в ладане, эфирных маслах, бальзамах. Нельзя не упомянуть и самую известную кислоту - лимонную. Способ её чистого получения был открыт в 1860 году и стал называться биосинтезом.
Тест для закрепления материала
-
1 Чем отличаются органические кислоты от неорганических?Вопрос 1 из 5
-
2 Каким способом получают органические кислоты?Вопрос 2 из 5
-
3 Органические кислоты классифицируются по:Вопрос 3 из 5
-
4 Общая формула сульфоновых кислот:Вопрос 4 из 5
-
5 Какие кислоты не относятся к органическим?Вопрос 5 из 5
Все тесты
- Биология
- Литература
- Обществознание
- Пунктуация
- Фонетический разбор
- Пушкин А.С
- Религия
- Карьера
- Информатика
- Физика
- Окружающий мир
- Стихи
- Математика
- Сочинения
- История
- ОБЖ
- Экономика
- Биографии
- Анализ стихотворений
- Русский язык
- Краткие содержания
- Физкультура
- Орфография
- География
- Помощь студенту
- Подготовка к ЕГЭ
- Тест на тему Что такое “железное легкое” и как жилось узникам аппарата 5 вопросов
- Тест на тему Суть и методы клеточной инженерии 5 вопросов
- Тест на тему Злаковые растения - общая характеристика, признаки и список представителей 7 вопросов
- Тест на тему Семейство бобовые - общая характеристика, строение и представители 7 вопросов
- Тест на тему Образы чиновников в комедии “Ревизор” Н. Гоголя 5 вопросов
- Тест на тему Роль образа вишневого сада в пьесе А. Чехова 5 вопросов
- Тест на тему Характеристика профессора Преображенского в повести “Собачье сердце” М. Булгакова 5 вопросов
- Тест на тему Описание образа городничего в комедии “Ревизор” Н. Гоголя 5 вопросов
- Тест на тему Описание образа главного героя “Доктора Живаго” Б. Пастернака 5 вопросов
- Тест на тему Образ Цыганка в повести “Детство” М. Горького 5 вопросов
- Тест на тему Характеристика Вани Солнцева в повести “Сын полка” В. Катаева 5 вопросов
- Тест на тему Образ автора в поэме "Василий Теркин" А. Твардовского 5 вопросов
- Тест на тему Образ портрета в повести "Портрет" Н. В. Гоголя 5 вопросов
- Тест на тему Описание образа девушки-ундины из “Героя нашего времени” М. Лермонтова 5 вопросов
- Тест на тему Описание образа Натальи Савишной в повести “Детство” Л. Толстого 5 вопросов
- Тест на тему Описание образа Костылина из “Кавказского пленника”. Л. Толстого 5 вопросов
- Тест на тему Описание образа Карла Ивановича в повести “Детство” Л. Толстого 5 вопросов
- Тест на тему Описание образа Жилина в “Кавказском пленнике” Л. Толстого 5 вопросов
- Тест на тему Описание образа Дины из “Кавказского пленника” Л. Толстого 5 вопросов
- Тест на тему Описание образа Вулича из “Героя нашего времени” М. Лермонтова 5 вопросов
- Тест на тему Описание образов татар в “Кавказском пленнике” Л. Толстого 5 вопросов
- Тест на тему Описание образа профессора Пирогова в рассказе “Чудесный доктор” А. Куприна 5 вопросов
- Тест на тему Народные образы героев в сказе «Серебряное копытце» П. Бажова 5 вопросов
- Тест на тему Описание образа Акакия Акакиевича Башмачкина из “Шинели” Н. Гоголя 5 вопросов
- Тест на тему Описание образов Лели и Миньки в одноименном рассказе М. Зощенко 5 вопросов
- Тест на тему Описание образа Сотникова из повести “Сотников” В. Быкова 5 вопросов
- Тест на тему Описание образов родителей в повести “Детство” Л. Толстого 5 вопросов
- Тест на тему Описание образа Флягина в “Очарованном страннике” Н. Лескова 5 вопросов
- Тест на тему Анализ комедии «Мещанин во дворянстве» Мольера 5 вопросов
- Тест на тему Описание образов героев рассказа “Галоша” М. Зощенко 5 вопросов
- Тест на тему Образ полковника - отца Вареньки из рассказа “После бала” Л. Толстого 5 вопросов
- Тест на тему Образ шинели в повести Н. В. Гоголя "Шинель" 5 вопросов
- Тест на тему Биография поэта Алексея Васильевича Кольцова 5 вопросов
- Тест на тему «Вечный зов» А. Иванова - краткое содержание 5 вопросов
- Тест на тему «Убийство в восточном экспрессе» А. Кристи - краткое содержание 5 вопросов
- Тест на тему Образ бабушки в повести «Детство» М. Горького 5 вопросов
- Тест на тему Описание образа барыни в рассказе «Муму» И. Тургенева 5 вопросов
- Тест на тему Главные произведения, написанные Александром Блоком 5 вопросов
- Тест на тему История создания песни “В лесу родилась елочка” 5 вопросов
- Тест на тему История создания поэмы “Двенадцать” А. Блока 5 вопросов
- Тест на тему История создания повести “Белые ночи” Ф. Достоевского 5 вопросов
- Тест на тему История создания балета «Щелкунчик» 5 вопросов
- Тест на тему "Пророк" - сравнительный анализ стихотворений А.С. Пушкина и М.Ю. Лермонтова 6 вопросов
- Тест на тему «Мика Морозов» - описание картины Валентина Серова 5 вопросов
- Тест на тему Любовная лирика С.А. Есенина - особенности и анализ творчества 5 вопросов
- Тест на тему История создания рассказа «Бежин луг» И. Тургенева 7 вопросов
- Тест на тему История создания пьесы «Вишневый сад» А. Чехова 6 вопросов
- Тест на тему История создания поэмы «Русские женщины» Н. Некрасова 6 вопросов
- Тест на тему История создания рассказа «Левша» Н. Лескова 5 вопросов
- Тест на тему История создания романа “Что делать” А. Чернышевского 7 вопросов
- Тест на тему История создания рассказа “После бала” Л. Толстого 7 вопросов
- Тест на тему История создания повести “Ася” И. Тургенева 7 вопросов
- Тест на тему 10 интересных фактов про Михаила Лермонтова 7 вопросов
- Тест на тему 10 интересных фактов про Льва Николаевича Толстого 7 вопросов
- Тест на тему "Банты" - как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Конечно же» - выделяется ли слово запятыми? 5 вопросов
- Тест на тему «Подчеркивать» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Лифты» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Строку» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Апостроф» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Зубчатый» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Прозорлива» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Балашиха» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Реку» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Полно» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Говорено» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Досыта» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Упрочение» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Развила» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Подолгу» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Логин» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Окон» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Втридорога» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Утра» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Запломбированный» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Цыган» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Шарфы» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Бармен» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Положенный» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Крадущийся» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Донизу» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Явишься» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Ободрить» - как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Предприняв» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Прочтено» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Низок» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Исчерпать» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Роба» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Исчерпывающий» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Будучи» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Понятым» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Повторен» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Изредка» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Донельзя» − как ставить ударение в слове? 5 вопросов
- Тест на тему «Загодя» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Принужден» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Опошлить» − как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Краны» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Торты» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Инструмент» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Брало» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Забрала» − как правильно ставить ударение? 5 вопросов
- Тест на тему «Отзыв» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Рефлексия» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему Образ Шарикова в повести «Собачье сердце» М. Булгакова 5 вопросов
- Тест на тему Образы героев в повести «Невский проспект» Н. Гоголя 5 вопросов
- Тест на тему Московские главы в романе «Мастер и Маргарита» Булгакова 7 вопросов
- Тест на тему Описание образа бирюка из рассказа И. Тургенева 7 вопросов
- Тест на тему Образы героев в романе «Отцы и дети» И. Тургенева 7 вопросов
- Тест на тему Образы героев в повести «Котлован» А. Платонова 7 вопросов
- Тест на тему Образы героев в пьесе «Гроза» А. Островского 7 вопросов
- Тест на тему История создания повести Н. В. Гоголя “Шинель” 7 вопросов
- Тест на тему История создания сборника рассказов Тургенева “Записки охотника” 7 вопросов
- Тест на тему История создания повести "Муму" Ивана Тургенева 7 вопросов
- Тест на тему История создания стихотворения "Реквием" Анны Ахматовой 10 вопросов
- Тест на тему История создания повести Гоголя "Тарас Бульба" 10 вопросов
- Тест на тему История создания стихотворения Пушкина "Деревня" 6 вопросов
- Тест на тему История создания стихотворения М. Лермонтова “Нищий” 7 вопросов
- Тест на тему История создания стихотворения "Она сидела на полу" 7 вопросов
- Тест на тему История создания Пушкиным стихотворения "К морю" 6 вопросов
- Тест на тему История создания повести «Станционный смотритель» А. Пушкина 10 вопросов
- Тест на тему История создания «Оды на день восшествия» М. Ломоносова 7 вопросов
- Тест на тему Тайны убийства Петра Столыпина 5 вопросов
- Тест на тему Отмена подушной подати на Руси 5 вопросов
- Тест на тему Период регентства Елены Глинской: события и реформы 5 вопросов
- Тест на тему Экономика России в годы Первой мировой войны 5 вопросов
- Тест на тему Битва при деревне Лесной 28 сентября 1708 года 5 вопросов
- Тест на тему 10 любопытных фактов про Рождество 5 вопросов
- Тест на тему 10 любопытных фактов про Новый год 5 вопросов
- Тест на тему История потешных полков Петра Первого 5 вопросов
- Тест на тему Образование и распад тушинского лагеря при Лжедмитрии II 5 вопросов
- Тест на тему Чем ведал и какие функции выполнял Разрядный приказ? 5 вопросов
- Тест на тему Задачи и направления внешней политики России в 16 веке 5 вопросов
- Тест на тему Установление и отмена бессрочного сыска беглых крестьян на Руси 5 вопросов
- Тест на тему История создания и деятельности Вольного экономического общества 5 вопросов
- Тест на тему Период правления Вещего Олега: внешняя и внутренняя политика 5 вопросов
- Тест на тему Правление и политика князя Игоря 5 вопросов
- Тест на тему Суть и последствия Нерчинского договора России с Китаем 1689 года 5 вопросов
- Тест на тему Причины, ход и итоги войны за польское наследство 1733-1735 гг. 5 вопросов
- Тест на тему Восстановление экономики СССР после Великой Отечественной Войны 5 вопросов
- Тест на тему Как и зачем были созданы полки иноземного строя 5 вопросов
- Тест на тему Создание стрелецких войск при Иване Грозном 5 вопросов
- Тест на тему Причины, ход событий и итоги выступления старообрядцев при Петре I 7 вопросов
- Тест на тему Как и почему началась Ливонская война: основные причины 5 вопросов
- Тест на тему К чему привела опричнина Ивана Грозного: последствия для страны 5 вопросов
- Тест на тему Положение черносошных крестьян на Руси 5 вопросов
- Тест на тему История Астраханского восстания: причины, события, итоги 7 вопросов
- Тест на тему Деятельность Великого посольства Петра I 5 вопросов
- Тест на тему Герои отечественной войны 1812 года - характеристика участников и полководцев 5 вопросов
- Тест на тему Развитие системы образования и науки в первой половине 19 века 6 вопросов
- Тест на тему Первые князья Киевской Руси - даты правления и особенности проводимой политики 7 вопросов
- Тест на тему Характеристика, периоды развития жизни в Палеозойскй эре 7 вопросов
- Тест на тему История праздника 23 февраля - происхождение и значение для России 7 вопросов
- Тест на тему Кто придумал отмечать 8 марта: история праздника 8 вопросов
- Тест на тему Славянские праздники - список праздников, обрядов и обычаев славян 10 вопросов
- Тест на тему Биография поэта и писателя Льва Рубинштейна 5 вопросов
- Тест на тему Биография президента Белоруссии Александра Лукашенко 5 вопросов
- Тест на тему 10 интересных фактов про Афанасия Фета 5 вопросов
- Тест на тему 10 интересных фактов про Ивана Тургенева 5 вопросов
- Тест на тему Биография писателя и поэта Вячеслава Урюпина 5 вопросов
- Тест на тему Биография поэта Николая Михайловича Рубцова 5 вопросов
- Тест на тему Биография поэта Андрея Дмитриевича Дементьева 5 вопросов
- Тест на тему Биография президента РФ Владимира Путина 5 вопросов
- Тест на тему Биография и личная жизнь Даниила Хармса 5 вопросов
- Тест на тему Краткая биография Валентины Осеевой 5 вопросов
- Тест на тему Григорий Остер: биография писателя и избранные произведения 7 вопросов
- Тест на тему Елена Благинина: творческая биография и личная жизнь 10 вопросов
- Тест на тему Биография детской писательницы Ирины Пивоваровой 5 вопросов
- Тест на тему Анализ стихотворения «Догорел апрельский светлый вечер…» И. Бунина 5 вопросов
- Тест на тему Анализ стихотворения «Фонтан» Ф. Тютчева 5 вопросов
- Тест на тему Анализ стихотворения «Посмотри - какая мгла» Я. Полонского 5 вопросов
- Тест на тему Анализ стихотворения «Школьник» Н. Некрасова 5 вопросов
- Тест на тему Анализ стихотворения «Несжатая полоса» Н. Некрасова 5 вопросов
- Тест на тему «Весенний дождь» - анализ стихотворения А.А. Фета 7 вопросов
- Тест на тему «Поет зима - аукает» - анализ стихотворения С.А. Есенина 7 вопросов
- Тест на тему Сообщение на тему: «Традиции русской речевой манеры общения» 5 вопросов
- Тест на тему Определение и виды простых осложненных предложений 5 вопросов
- Тест на тему Какие бывают виды текстов? 5 вопросов
- Тест на тему Образование и правописание страдательных причастий настоящего времени 5 вопросов
- Тест на тему Как определить начальную форму прилагательного? 5 вопросов
- Тест на тему Местоимение-прилагательное в русском языке 5 вопросов
- Тест на тему Сборник правил по русскому языку для 6 класса 7 вопросов
- Тест на тему Сборник правил по русскому языку за 5 класс 7 вопросов
- Тест на тему Упражнения для тренировки школьников 7 класса по причастному обороту 9 вопросов
- Тест на тему Тест: Склонение фамилий в русском языке 7 вопросов
- Тест на тему Общеупотребительные и необщеупотребительные слова 5 вопросов
- Тест на тему Дефисное и слитное написание сложных прилагательных 5 вопросов
- Тест на тему Морфологический разбор числительного - правило и примеры 5 вопросов
- Тест на тему «Акула» Л. Толстого - краткое содержание 5 вопросов
- Тест на тему Русская народная сказка «Хвосты» - краткое содержание 5 вопросов
- Тест на тему Краткое содержание оперы «Снегурочка» Римского-Корсакова 5 вопросов
- Тест на тему «Обезьяний язык» М. Зощенко – краткое содержание 10 вопросов
- Тест на тему «Сердце не камень» - краткое содержание пьесы А.Н. Островского 5 вопросов
- Тест на тему Балет «Щелкунчик» — краткое содержание 7 вопросов
- Тест на тему Реферат по физкультуре на тему: «Здоровое питание» 5 вопросов
- Тест на тему История развития лыжного спорта в разных странах - классификация и интересные факты 6 вопросов
- Тест на тему Важность самоконтроля при занятиях спортом 5 вопросов
- Тест на тему Как выполняются прыжки через козла? 5 вопросов
- Тест на тему Что такое здоровый образ жизни? 5 вопросов
- Тест на тему Как правильно выполнять кувырки? 5 вопросов
- Тест на тему Развитие гибкости тела: упражнения и польза для тела 5 вопросов
- Тест на тему Виды и польза прыжков через скакалку 5 вопросов
- Тест на тему Какие есть зимние виды спорта? 5 вопросов
- Тест на тему Реферат на тему: “Гимнастика как вид спорта” 8 вопросов
- Тест на тему Реферат по физкультуре на тему “Футбол” 7 вопросов
- Тест на тему Реферат по физкультуре на тему: “Баскетбол - виды и лиги” 7 вопросов
- Тест на тему Реферат на тему «Лыжный спорт» 10 вопросов
- Тест на тему Реферат по физической культуре «Формы и виды закаливания» 10 вопросов
- Тест на тему Правописание слов с непроверяемой безударной гласной в корне 5 вопросов
- Тест на тему Нужно ли ставить запятую к фразе - "с уважением"? 5 вопросов
- Тест на тему «Во-вторых» или «во вторых» – как правильно пишется? 5 вопросов
- Тест на тему "Нету" или "нет" - как правильно писать и говорить? 5 вопросов
- Тест на тему «Не я» или «нея» – как правильно пишется? 5 вопросов
- Тест на тему «Полным-полно» или «полным полно» - как правильно пишется? 5 вопросов
- Тест на тему Как пишется «кто-нибудь» или «кто нибудь»? 5 вопросов
- Тест на тему Мягкий знак после шипящих в глаголах - правила, примеры 5 вопросов
- Тест на тему «Потвёрже» или «по твёрже» – как правильно пишется? 5 вопросов
- Тест на тему «Какой-то» или «какой то» – как пишется правильно? 5 вопросов
- Тест на тему «Мало-помалу» или «мало помалу» – как правильно пишется? 5 вопросов
- Тест на тему «По-осеннему» или «по осеннему» – как правильно пишется? 5 вопросов
- Тест на тему "Находу" или "на ходу" - слитно или раздельно писать? 5 вопросов
- Тест на тему "ЮлИчка" или "ЮлЕчка" - как правильно писать? 5 вопросов
- Тест на тему «Не пойму» или «непойму» – как правильно пишется? 5 вопросов
- Тест на тему «Доброе утро» − как правильно пишется? 5 вопросов
- Тест на тему «Почему-то» или «почему то» – как правильно пишется? 5 вопросов
- Тест на тему «На вынос» или «навынос» – как правильно пишется? 5 вопросов
- Тест на тему «Невежливо» или «не вежливо» – как правильно пишется? 5 вопросов
- Тест на тему «Негодуя» или «не годуя» - как правильно пишется? 5 вопросов
- Тест на тему «КуриНый» или «куриННый» − как правильно пишется? 5 вопросов
- Тест на тему «ТеННис» или «теНис» – как правильно пишется? 5 вопросов
- Тест на тему «ТумаННый» или «тумаНый» – как правильно пишется? 5 вопросов
- Тест на тему «ЗамечеННый» или «замечеНый» – как правильно пишется? 5 вопросов
- Тест на тему «Семнадцать» или «семЬнадцать» – как правильно пишется? 5 вопросов
- Тест на тему «ВыздОравливающий» или «выздАравливающий» – как правильно пишется? 5 вопросов
- Тест на тему «Свеж» или «свежЬ» – как правильно пишется? 5 вопросов
- Тест на тему «СлаЩе» или «слаДЧе» – как правильно пишется? 5 вопросов
- Тест на тему «ПрЕтерпевать» или «прИтерпевать» - как правильно пишется? 5 вопросов
- Тест на тему «Удастся» или «удастЬся» – как правильно пишется? 5 вопросов
- Тест на тему «СписаНо» или «СписаННо» – как правильно пишется? 5 вопросов
- Тест на тему «Происшествие» или «проишествие» – как правильно пишется? 5 вопросов
- Тест на тему «НачИнающий» или «начЕнающий» – как правильно пишется? 5 вопросов
- Тест на тему «Невозможно» или «не возможно» – как пишется слитно или раздельно? 5 вопросов
- Тест на тему «Налету» или «на лету» – как правильно пишется? 5 вопросов
- Тест на тему «Надолго» или «на долго» – как правильно пишется? 5 вопросов
- Тест на тему «ПьющАя» или «пьющЕя» – как правильно пишется? 5 вопросов
- Тест на тему «Неужели» или «не ужели» − как правильно пишется? 5 вопросов
- Тест на тему «НИкого» или «нЕкого» – как правильно пишется? 5 вопросов
- Тест на тему «БаССейн» или «баСейн» − как правильно пишется? 5 вопросов
- Тест на тему "Не согласованно" или "несогласованно" - слитно или раздельно? 5 вопросов
- Тест на тему «ОбстОятельствам» или «обстАятельствам» – как правильно пишется? 5 вопросов
- Тест на тему «ОбижеННый» или «обижеНый» – как правильно пишется? 5 вопросов
- Тест на тему «Аллах» или «Алах» – как правильно пишется? 5 вопросов
- Тест на тему «БелОрусский» или «белАрусский» – как правильно пишется? 5 вопросов
- Тест на тему «ЧИсло» или «чЕсло» – как правильно пишется? 5 вопросов
- Тест на тему «УвЕряющий» или «увИряющий» – как правильно пишется? 5 вопросов
- Тест на тему «НенасТный» или «ненасный» – как правильно пишется? 5 вопросов
- Тест на тему «Постричь» или «поДстричь» – как правильно пишется? 5 вопросов
- Тест на тему «КоЛея» или «коЛЛея» – как правильно пишется? 5 вопросов
- Тест на тему Характеристика природных зон Поволжья 5 вопросов
- Тест на тему Для каких рек в России характерно летнее половодье? 5 вопросов
- Тест на тему Как правильно заполнять дневник наблюдения за погодой 5 вопросов
- Тест на тему Влажные экваториальные леса - особенности климата, характеристика флоры и фауны 7 вопросов
- Тест на тему Европейский север России - географическое положение, особенности развития предприятий и промышленности 7 вопросов
- Тест на тему Что такое масштаб карты и как его определять 7 вопросов
- Тест на тему Особенности и примеры островных государств 5 вопросов
- Тест на тему Природные зоны Южной Америки - характеристики и особенности 7 вопросов
- Тест на тему 10 интересных фактов про океан 7 вопросов
- Тест на тему Сектор Газа: где он находится и откуда такое название? 6 вопросов
- Тест на тему Что нужно сдавать на бухгалтера? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на пилота 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на фотографа? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на хореографа? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на актера? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на режиссера? 5 вопросов
- Тест на тему Что нужно сдавать на художника? 5 вопросов
- Тест на тему Что нужно сдавать для поступления на визажиста? 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на полицейского? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на фармацевта? 5 вопросов
- Тест на тему Какие предметы сдавать для поступления на врача? 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на учителя 5 вопросов
- Тест на тему Кадетский корпус - как поступить, чему учат и условия для проживания 5 вопросов
- Тест на тему Готовы ли вы к поступлению на психолога? 5 вопросов
- Тест на тему Готовы ли вы к поступлению на дизайнера? 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на стюардессу? 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на повара? 5 вопросов
- Тест на тему Какие предметы сдавать для поступления на программиста 5 вопросов
- Тест на тему Готовы ли вы сдавать экзамены на стоматолога? 5 вопросов
- Тест на тему Готовы ли вы сдавать экзамены на маркетолога? 5 вопросов
- Тест на тему Готовы ли вы сдавать экзамены на ветеринара? 5 вопросов
- Тест на тему Готовы ли вы поступать на экономиста? 5 вопросов
- Тест на тему Готовы ли вы к поступлению на юриста? 5 вопросов
- Тест на тему Готовы ли вы поступать на архитектора? 5 вопросов
- Тест на тему Аргументы к сочинению на тему: «Добро и зло в пьесе “Гроза” А. Островского» 5 вопросов
- Тест на тему Аргументы к сочинению 15.3 из пьесы «Горе от ума» 5 вопросов
- Тест на тему Аргументы к итоговому сочинению по рассказу «Матренин двор» А. Солженицына 5 вопросов
- Тест на тему Аргументы для итогового сочинения ЕГЭ по роману «Мастер и Маргарита» 5 вопросов
- Тест на тему Аргументы к итоговому сочинению по рассказу «Куст сирени» 5 вопросов
- Тест на тему Аргументы для итогового сочинения ЕГЭ по «Гарри Поттеру» 5 вопросов