Основные понятия и законы химии - список химических терминов, обозначений и формул
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений.Химические явления: одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом состав ядер атомов не изменяется. Физические явления: меняется физическое состояние веществ (парообразование, плавление, электропроводность, выделение тепла и света, ковкость и др.) или образуются новые вещества с изменением состава ядер атомов. В статье представлены основные понятия и законы химии, которые собраны в одном месте.
Основные понятия химии
Атом — мельчайшая, химически неделимая, электронейтральная частица вещества. Состоит из ядра и электронной оболочки.
Каждый атом принадлежит определённому химическому элементуw. Элемент имеет название, порядковый номер, и положение в периодической таблице Менделеева. В настоящее время известно 118 химических элементов, заканчивая Uuo (Ununoctium — унуноктий). Каждый элемент обозначен символом, который представляет одну или две буквы из его латинского названия (водородw обозначен буквой H — первой буквой его латинского названия Hydrogenium).
Атомно - молекулярное учение.
- Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
- Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы. 3 Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания
Вещество — вид материи с определёнными химическими и физическими свойствами. Совокупность атомов, атомных частиц или молекул, находящаяся в определённом агрегатном состоянии. Из веществ состоят физические тела (медь — вещество, а медная монета — физическое тело).
Валентность — количество химических связей, которое образует один атом.
Молекула — наименьшая частица вещества, сохраняющая его химические свойства. Состоит из атомов.
Свойства — совокупность признаков по которым одни вещества отличаются от других, они бывают химическими и физическими.
Физические свойства — признаки вещества, при характеристике которых вещество не изменяет свой химический состав (плотность, агрегатное состояние, температуры плавления и кипения и т. п.)
Химические свойства — способность веществ взаимодействовать с другими веществами или изменяться под действием определённых условий. Результатом является превращение одного вещества или веществ в другие вещества.
Агрегатные состояния а веществ— состояние вещества, характеризующееся определенными свойствами (способность сохранять форму, объем). Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазмуw. Существуют и другие агрегатные состояния, например, жидкие кристаллыw или конденсат Бозе — Эйнштейнаw.
Моль — мера количества вещества, содержащая Число Авогадроw (NA ≈ 6,02 × 1023) любых структурных частиц. (NA — количество атомов в 12 граммах углерода 12Cw.)
Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов». Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является Периодическая система химических элементовw, первоначальный вариант которой был разработан Д. И. Менделеевым в 1869—1871 годах.
Простое вещество — вещество, состоящее из атомов одного химического элемента: водород, кислород и т. д.
Сложное вещество — вещество, состоящее из атомов разных химических элементов: кислоты, вода и др.
Относительная атомная масса — масса (а. е. м.) 6,02 × 1023 молекул простого вещества, где а. е. м. — атомная единица массыw.
Относительная молекулярная масса — масса (а. е. м.) 6,02 × 1023 молекул сложного вещества. Численно равна молярной массе, но отличается размерностью.
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристаллаw как целого. Химическая связь определяется взаимодействием между заряженными частицамиw (ядрамиw и электронамиw).
Полимеры — высокомолекулярные соединения, молекулы которых состоят из повторяющихся фрагментов (структурных звеньев).
Степень полимеризации — число структурных звеньев, входящих в состав макромолекулы.
Гомополимеры — полимеры, образованные из одинаковых по составу и строению мономеровw.
Мономер — низкомолекулярное вещество, образующее полимер в реакции полимеризацииw.
Сополимеры — полимеры, образованные из двух и более мономеров.
Сополимеризация — реакция полимеризации с участием двух или более различных мономеров.
Электрохимия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов.
Электродный потенциал — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Электролит — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Гомологический ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую «гомологическую разность».
Изомерия — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Изомеры — соединения, обладающие одинаковым элементарным составом, но различным химическим строением.
Химическое равновесие — это такое состояние системы, когда скорость прямой реакции равна скорости обратной реакции.
Тепловой эффект реакции — это теплота, которая выделяется или поглощается системой при течении в ней химической реакции. В зависимости от того, происходит реакция с выделением теплоты или сопровождается поглощением теплоты, различают экзо-и эндотермические реакции. К первым, как правило, относятся все реакции соединения, а ко вторым — реакции разложения.[1]
Катализатор — это вещество, которое изменяет скорость химической реакции, но количественно при этом не расходуется и в состав продуктов не входит.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов.
Теплота — количественная мера хаотичного движения частиц данной системы, при этом не происходит переноса вещества от одной системы к другой.
Тепловой эффект — выделение или поглощение тепловой энергии системой при протекании в ней химической реакции, при условии, что система не совершает никакой другой работы кроме работы расширения.
Внутренняя энергия системы — суммарная энергия внутренней системы, включающая энергию взаимодействия и движения молекул, атомов, ядер, электронов в атомах, внутриядерную и другие виды энергии, кроме кинетической и потенциальной энергии системы, как целого.
Энтальпия — это энергия расширенной системы (термодинамическая функция, характеризующая систему, находящуюся при постоянном давлении).
Стандартная энтальпия (теплота) образования сложного вещества — тепловой эффект реакции образования 1 моля этого вещества из простых веществ, находящихся в устойчивом агрегатном состоянии при стандартных условиях (= 298 К и давлении 101 кПа).
Гомогенная система — однородная система, химический состав и физические свойства которой во всех частях одинаковы или меняются непрерывно, без скачков (между частями системы нет поверхностей раздела). В гомогенной системе из двух и более химических компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем.
Гетерогенная система — неоднородная система, состоящая из однородных частей (фаз), разделённых поверхностью раздела. Однородные части (фазы) могут отличаться друг от друга по составу и свойствам.
Скорость гомогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Скорость гетерогенной реакции — количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.[
Термодинамика — раздел науки, изучающий соотношения и превращения теплоты и других форм энергии. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Она изучает макроскопические системы, состоящие из огромного числа частиц — термодинамические системы.
Термодинамическая система — некая физическая система, состоящая из большого количества частиц, способная обмениваться с окружающей средой энергией и веществом. Также обычно полагается, что такая система подчиняется статистическим закономерностям.
Первый закон термодинамики — для изолированной системы (для которой исключен любой материальный или энергетический обмен с окружающей средой) внутренняя энергия постоянна.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. В настоящее время известно 110 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов. Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N. Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N. Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Химическая формула - это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс - цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Аллотропия - явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам. Простые вещества- молекулы, состоят из атомов одного и того же элемента.
Cложные вещества - молекулы, состоят из атомов различных химических элементов.
Химическим эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Масса 1 эквивалента вещества называется эквивалентной массой (mэкв).
Эквивалентную массу соединения можно определить по его химической формуле, например,
m экв(оксида) = М (оксида)/(число атомов кислорода*2);
m экв(основания) = М (основания)/число гидроксильных групп;
m экв(кислоты) = М кислоты/число протонов;
m экв(соли) = М соли /(число атомов металла*валентность металла).
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который гласит, что химические элементы соединяются между собой или замещают друг друга в количествах, пропорциональных их молярным массам эквивалентов:
m1/m2=Мэкв1/ Мэкв2, где
где m1 и m2 — массы реагирующих или образующихся веществ, m экв1 и m экв2 — эквивалентные массы этих веществ.
Ион - это заряженная частица, атом или молекула, которая имеет неодинаковое количество протонов и электронов. Если у частицы больше электронов, чем протонов, то она заряжена отрицательно и называется анион. Например — Cl−. Если в частице электронов меньше, чем протонов, значит, она заряжена положительно и называется катион. Например — Na+.
Радикал - это частица (атом или молекула), содержащая один или несколько неспаренных электронов. В большинстве случаев химическая связь образуется при участии двух электронов. Частица, имеющая неспаренный электрон, очень активна и легко образует связи с другими частицами. Поэтому время жизни радикала в среде, как правило, очень мало.
Основные законы химии
Закон сохранения массы веществ
Закон сохранения массы теоретически был описан в 1748 году, а экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым. Ломоносов определил, что если сосуд с металлом взвесить до и после нагревания, не вскрывая его, то масса останется неизменной.
В 1789 году французский учёный Антуан Лавуазье подтвердил выводы Ломоносова.
Закон сохранения массы веществ формулируется так:
Масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Атомно-молекулярное учение объясняет этот закон так: при химической реакции общее количество участвующих атомов не изменяется, а происходит лишь их перегруппировка. Так как число атомов до и после реакции не изменяется, то их общая масса тоже не изменяется.
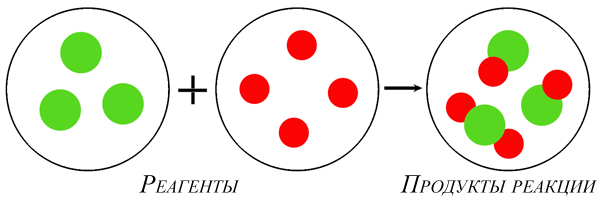
Модель химической реакции
На основе закона сохранения массы веществ проводят количественный химический анализ.
Приведём пример. Составим химическое уравнение реакции разложения воды:
H2O → H2 + O2,
Число атомов кислорода слева от стрелки, т.е. до реакции, меньше в два раза, чем справа, т.е. после реакции. Для уравнивания количества веществ до и после реакции, нужно поставить коэффициент 2 перед формулой воды в левой части уравнения:
2H2O → H2 + O2
Ещё пример:
Ag + S → Ag2S
2Ag + S = Ag2S
Зная закон сохранения массы, можно сформулировать правила составления химических уравнений:
- Необходимо знать формулы веществ, вступивших в реакцию (реагентов) и формулы веществ, полученных в результате реакции (продукты реакции).
- Число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этих же элементов в правой части уравнения. Для уравновешивания подбирают и расставляют перед формулами соответствующие коэффициенты.
- Левую и правую части уравнения нельзя менять местами.
- Нельзя переносить формулы веществ из одной части уравнения в другую.
Закон постоянства состава
Закон постоянства состава впервые сформулировал в 1808г. французский учёный-химик Жозеф Луи Пруст.
Закон постоянства состава формулируется так:
Вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав.

Вещества с постоянным составом названы дальтонидами в честь английского химика Джона Дальтона.
Состав дальтонидов описывается химическими формулами с целыми стехиометрическими коэффициентами, например Н2О, НCl, СН4, СO2, С2Н5ОН.
Из закона постоянства состава следует, что при образовании сложного вещества элементы простых веществ соединяются друг с другом в строго определенных массовых долях.
Массовая доля элемента ωЭ показывает, какую часть составляет масса данного элемента от массы всего вещества, где:
n – число атомов;
ArЭ – относительная атомная масса элемента;
Mr – относительная молекулярная масса вещества.
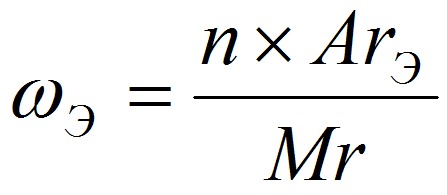
Развитие химии показало, что наряду с веществами, имеющими постоянный состав, существуют вещества с переменным составом, который зависит от способа получения. Такие вещества назвали в честь французского химика Клода Бертолле – бертоллидами.
Бертоллиды не подчиняются законам стехиометрии. Примеры бертоллидов есть в классах оксидов, сульфидов, карбидов, гидридов и пр.
Исходя из вышеизложенного, уточним формулировку закона постоянства состава:
Состав соединений с молекулярной структурой является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Периодический закон
Периодический закон сформулирован Д. И. Менделеевым в
Расположив все известные химические элементы в порядке возрастания атомных масс, Менделеев обнаружил, что свойства повторяются через определённое число элементов.
Повторим действия Менделеева с учётом того факта, что благородные газы в его время ещё не были известны. Расположим элементы по возрастанию атомной массы (вторая строчка таблицы), укажем металлические и неметаллические свойства, формулы и свойства высших оксидов и гидроксидов, а также формулы газообразных водородных соединений.
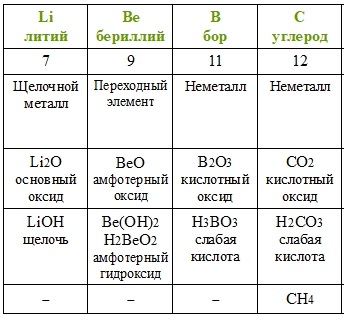
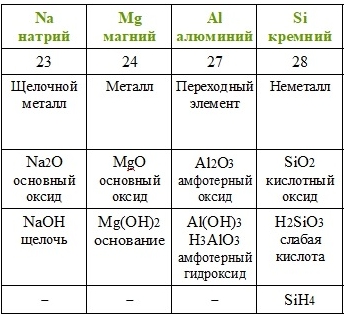
Если внимательно проанализировать полученные последовательности, то можно увидеть повторяемость металлических и неметаллических свойств, состава и свойств соединений. Через семь элементов от щелочного металла лития в ряду располагается щелочной металл натрий, а через семь элементов от галогена фтора — галоген хлор. Через семь элементов появляются одинаковые формулы оксидов и водородных соединений, так как повторяются значения валентностей в соединениях с кислородом и водородом. Можем составить их общие формулы.
Формулы высших оксидов:
Летучие водородные соединения (для неметаллов):
Таким образом Менделеев установил периодичность изменения свойств с возрастанием атомной массы. В статье «Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от атомного веса».
В переводе на современный научный язык это звучит так:
«Свойства простых веществ, а также состав и свойства соединений элементов находятся в периодической зависимости от относительных атомных масс».
Все элементы Менделеев разделил на периоды.
Период — ряд элементов, расположенных в порядке возрастания относительной атомной массы, начинающийся щелочным металлом и заканчивающийся галогеном и инертным газом. В периоде:
- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от
I (у щелочных металлов) доVII (у галогенов); - валентность элементов неметаллов в летучих водородных соединениях уменьшается от
IV доI (у галогенов); - свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
Периодический закон получил дальнейшее развитие после изучения физиками строения атома. Оказалось, что главной характеристикой химического элемента является не относительная атомная масса, а заряд ядра атома.
Современная формулировка периодического закона несколько изменена:
«Свойства химических элементов и их соединений находятся в периодической зависимости от зарядов атомных ядер».
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется способность атомов данного элемента присоединять или замещать определенное число других атомов. max вал. = 8.
Закон сохранения массы
Полная механическая энергия замкнутой системы тел остается неизменной.
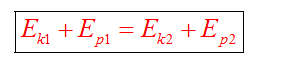
Закон сохранения энергии можно представить в виде:
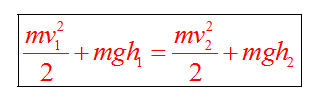
Если между телами действуют силы трения, то закон сохранения энергии видоизменяется. Изменение полной механической энергии равно работе сил трения.
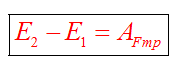
Рассмотрим свободное падение тела с некоторой высоты h1. Тело еще не движется (допустим, мы его держим), скорость равна нулю, кинетическая энергия равна нулю. Потенциальная энергия максимальная, так как сейчас тело находится выше всего от земли, чем в состоянии 2 или 3.
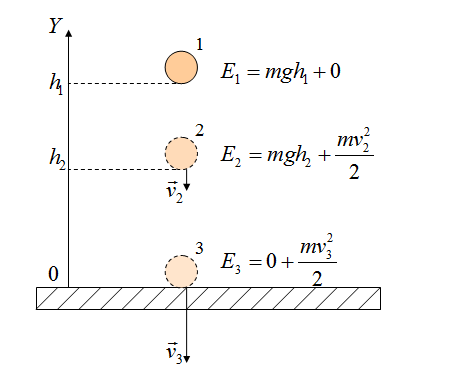
В состоянии 2 тело обладает кинетической энергией (так как уже развило скорость), но при этом потенциальная энергия уменьшилась, так как h2 меньше h1. Часть потенциальной энергии перешло в кинетическую.
Состояние 3 - это состояние перед самой остановкой. Тело как бы только-только дотронулось до земли, при этом скорость максимальная. Тело обладает максимальной кинетической энергией. Потенциальная энергия равна нулю (тело находится на земле).
Полные механические энергии равны между собой, если пренебрегать силой сопротивления воздуха. Например, максимальная потенциальная энергия в состоянии 1 равна максимальной кинетической энергии в состоянии 3.
А куда потом исчезает кинетическая энергия? Исчезает бесследно? Опыт показывает, что механическое движение никогда не исчезает бесследно и никогда оно не возникает само собой. Во время торможения тела произошло нагревание поверхностей. В результате действия сил трения кинетическая энергия не исчезла, а превратилась во внутреннюю энергию теплового движения молекул.
При любых физических взаимодействиях энергия не возникает и не исчезает, а только превращается из одной формы в другую.
Общая форма закона сохранения и превращения энергии имеет вид:
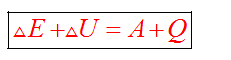

Изучая тепловые процессы, мы будем рассматривать формулу
При исследовании тепловых процессов не рассматривается изменение механической энергии, то есть
В механике процессы теплопередачи не принимают во внимание, то есть. Если рассматривается физическая система замкнутая, то, получим . А если в замкнутой системе действуют только консервативные силы, то и приходим к формулировке: полная механическая энергия замкнутой системы тел, в которой действуют только консервативные силы, сохраняется.
Закон эквивалентов
Эквивалент (Э) – реальная или условная частица вещества, которая может присоединить, заместить в кислотно-основных реакциях один ион водорода (или другого одновалентного элемента), а в окислительно-восстановительных реакциях – присоединить или высвободить один электрон.
Под условной частицей вещества подразумевается реально существующие частицы (молекулы, ионы, электроны и т.д.), доли этих частиц (например, 1/2 иона) или их группы.
Фактор эквивалентности fэ (х) – число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в реакции окисления-восстановления.
Фактор эквивалентности – величина безразмерная. Принимает значения 1 или меньше единицы.
Для простых веществ и элементов в соединении fэ(х) = 1/В, где В – валентность элемента.
Например, для водорода или натрия fэ= 1/1 = 1. Для магния или кислорода fэ = 1/2.
Молярная масса эквивалента вещества Мэ(х) – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности fэ(х) на молярную массу вещества Мх.
Мэ(х) = fэ (х) · Мх (кг/моль, г/моль).
Например, молярные массы эквивалентов простых веществ:
Мэ(Н) = 1 · 1 г/моль;
Мэ(Na) = 1· 23 = 23 г/моль;
Мэ(Mg) = ½ · 24 = 12 г/моль;
Mэ(О) = ½ · 16 = 8 г/моль.
Если одно из реагирующих веществ – газ, то для него вводится понятие объема эквивалента вещества – Vэ(х), который рассчитывается на основании следствия из закона Авогадро:
1 моль газа массой М занимает объем 22,4 л, при нормальных условиях (н.у.):
Рo = 1 атм.; То = 273 К
1 эквивалент газа массой Мэ занимает объем Vэ при н.у.
отсюда Vэ = 22,4 · Мэ / М (л/моль);
Например, при нормальных условиях 1 моль эквивалентов водорода занимает объем, равный:
Vэ (Н2) = 22,4 · 1 / 2 = 11,2 л/моль.
Для кислорода эта величина составляет
Vэ (О2) = 22,4 · 8 / 32 = 5,6 л/моль.
Закон эквивалентов: массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ.
m1 / m2 = Mэ (1) / Мэ (2).
Если одно из этих веществ представляет собой газ, то закон эквивалентов записывается в виде:
m1 / Мэ(1) = V2 / Vэ (2).
Закон кратных отношений
Относительные атомные и молекулярные массы являются мерой масс атомов и молекул, поэтому они позволяют сделать вывод о соотношении масс атомов различных элементов в молекуле сложного вещества.
Пример: Относительная атомная масса водорода и кислорода соответственно равна 1,00794 и 15,9994, откуда следует, что соотношение масс атомов водорода и кислорода составляет 1 : 16. В молекуле воды H2O содержится два атома водорода и один атом кислорода, следовательно, массовое отношение водорода и кислорода в воде равно 2 : 16 или 1 : 8.
Соотношение атомных масс элементов в соединениях устанавливает закон постоянства состава, вывел его в начале XIX в. французский химик Жозеф Луи Пруст (1754-1826) на основании анализа химических соединений.
Его современная формулировка такова:
Каким бы способом ни было получено вещество, его химический состав остается постоянным
В каждом сложном веществе (независимо от способа его получения) сохраняются неизменными соотношения чисел атомов и масс атомов входящих в его состав элементов. При этом, отношение чисел атомов различных элементов выражается небольшими целыми числами. Так, для воды H2O они составляют 2 : 1, для диоксида углерода CO2 - 1 : 2, для оксида азота (III) N2O3 - 2 : 3. Эти числа и определяют состав указанных сложных веществ.
Отсюда следует, что если два или несколько простых веществ соединяются с образованием некоторого сложного вещества, то и массовое отношение реагирующих веществ постоянно для данного продукта. Так, при взаимодействии водорода и кислорода могут быть получены вода H2O и пероксид водорода H2O2; очевидно, что не только в самих продуктах массовое отношение водорода и кислорода равно соответственно 1 : 8 и 1 : 16, но и массовые отношения реагентов будут такими же.
На основании закона постоянства состава и закона кратных отношений английский исследователь Джон Дальтон (John Dalton, 1766-1844) в 1807 г. высказал атомную гипотезу (основу атомно-молекулярного учения о строении вещества):
Любое вещество составлено из мельчайших химических частиц - атомов; простое вещество состоит из атомов одного элемента, сложное вещество - из атомов различных элементов.
Из атомной гипотезы вытекает, что закон постоянства состава отражает именно атомный состав вещества: в молекулу вещества объединяется определенное число именно атомов одного или различных элементов.
Закон кратных отношений, открытый Дальтоном, гласит:
Если два элемента образуют между собой несколько соединений, то массы атомов одного элемента, приходящиеся на одну и ту же массу атомов другого элемента, соотносятся между собой как небольшие целые числа.
Пример: Сера образует два оксида - диоксид SO2 и триоксид SO3. Относительная атомная масса серы и кислорода равна 32 и 16 (округлено). Массовое отношение серы и кислорода в SO2 равно 32 : (2·16) = 32 : 32, в SO3 32 : (3·16) = 32 : 48. Отсюда следует, что на каждые 32 массовые части серы в этих соединениях приходится 32 и 48 массовых частей кислорода соответственно, т.е. а после сокращения в соответствии с математическими законами, соотношение массовых частей кислорода 32 : 48 = 2 : 3, что и является отношением небольших кратных чисел.
Закон кратных отношений является фактическим объединением закона сохранения массы и закона постоянства состава на базе атомной гипотезы строения вещества.
Закон объемных отношений (закон Гей-Люссака)
Закон объёмных отношений впервые сформулировал в 1802 г французский учёный-химик Жозеф Луи Гей-Люссак.
Закон объёмных отношений формулируется так:
Объёмы вступающих в реакцию газов относятся друг к другу и к объёмам образующихся продуктов реакции как небольшие целые числа.
При этом подразумевается, что давление и температура неизменны. Другими словами, стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объёмных отношениях реагируют и получаются газообразные вещества.
Пример:
2Н2 + О2 →2Н2О,
При взаимодействии 2 объёмов водорода и 1 объёма кислорода образуются 2 объёма водяного пара.
Закон Авогадро
Изучение свойств газов позволило итальянскому физику А. Авогадро в 1811г. высказать гипотезу, которая впоследствии была подтверждена опытными данными, и стала называться законом Авогадро:
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: моль любого газа при нормальных условиях (0
Из закона Авогадро также следует, что массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу как молярные массы этих газов:
где m1 и m2 – массы,
М1 и М2 – молекулярные массы первого и второго газов.
Поскольку масса вещества определяется по формуле
где ρ – плотность газа,
V – объем газа,
то плотности различных газов при одинаковых условиях пропорциональны их молярным массам. На этом следствии из закона Авогадро основан простейший метод определения молярной массы веществ, находящихся в газообразном состоянии.
Закон Авогадро позволяет рассчитать плотность газа при нормальных условиях, на основании отношения молярной массы М к объему моля:
Из этого уравнения можно определить молярную массу газа:
Следствия из закона Авогадро
Из закона Авогадро вытекают два важных следствия.
Следствие 1 из закона Авогадро. Один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности при нормальных условиях объем одного моля идеального газа равен 22,4 л. Этот объем называют молярным объемом.
Следствие 2 из закона Авогадро. Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью.
Объединенный газовый закон
Характерной особенностью газообразного состояния является то, что практически отсутствуют силы взаимного притяжения между молекулами вещества, и они не способны удерживаться друг возле друга. Поэтому газы могут неограниченно расширяться, занимая весь предоставленный им объем. В технологических процессах объем и форма газообразного тела идентичны объему и форме технологического пространства, в котором он находится (сосуд, автоклав, цилиндр поршня, внутреннее пространство плавильной печи и т. д.). Незначительность сил молекулярного взаимодействия между частицами газа позволяет ввести понятие «идеальный газ».
Идеальный газ - это такой гипотетический газ, молекулы которого не взаимодействуют друг с другом и занимают нулевой объем. Соотношения между давлением, объемом и температурой газов устанавливают законы идеальных газов: объединенный газовый закон, законы для изобарического, изохорического и изотермического процессов.
Реальные газы обычно хорошо подчиняются законам идеальных газов при давлениях, менее или несущественно превышающих атмосферное, и при температурах близких к температуре окружающей среды или более высоких. Поэтому законы идеальных газов находят широкое применение в природопользовании, в частности при расчетах количества, состава газов, выделяющихся при горении, и в других технологических процессах, сопровождаемых их образованием.
Объединяя законы Бойля - Мариотта и Гей-Люссака (уравнения 1 и 2), можно получить следующее уравнение:
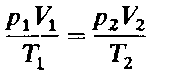
которое является математическим выражением объединенного газового закона, или закона состояния газов. Он позволяет вычислить, например, объем газа при определенных температуре и давлении, если известен его объем при других значениях температуры и давления.
Объединенный газовый закон можно также записать в другой форме:
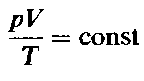
Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение
R = 8,314 Дж*К* моль-1
Объединенный газовый закон для одного моля газа приобретает вид:
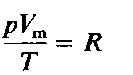
где Vm- объем одного моля газа. Для п молей газа получается уравнение:
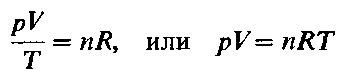
В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру.
Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах. Отклонения в поведении реальных газов от предписываемых уравнением состояния идеального газа подробно обсуждаются ниже.
Вычисление относительной молекулярной массы с помощью уравнения состояние идеального газа. Уравнение состояния идеального газа позволяет проводить прямые вычисления относительной молекулярной массы газа M1. Введем понятие относительной молекулярной массы, основываясь на уже знакомом нам (из гл. 1) определении относительной атомной массы A1. Для газа, состоящего из простых молекул, относительная молекулярная масса представляет собой сумму относительных атомных масс всех атомов, входящих в молекулу. Например, для диоксида углерода.
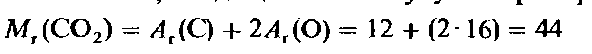
Относительная молекулярная масса, выраженная в граммах на моль, называется молярной массой (см. гл. 4). Следовательно, молярная масса CO2 равна 44 г/моль. Два моля CO2 имеют массу 88 г, а и молей-массу п -44 г. В общем случае можно записать:
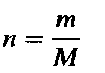
где n-количество вещества в молях (т.е. число молей данного вещества), т-масса вещества в граммах, a M-его молярная масса.
Подстановка полученного выражения для п в уравнение состояния идеального газа (4) дает:
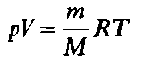
Это уравнение позволяет, зная массу и объем газа при определенных температуре и давлении, вычислить его молярную массу М. А поскольку
M = M (г/моль), то полученный результат непосредственно дает относительную молекулярную массу М.
Уравнение Клайперона—Менделеева (для идеального газа)
Уравнение Клапейрона-Менделеева (1834 г) устанавливает связь между объемом V, давлением P и абсолютной температурой Т для газа:
PV = nRT,
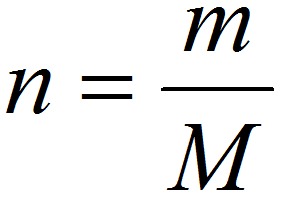
где:
n – число молей газа;
P – давление газа, Па;
V – объем газа, м3;
T – абсолютная температура газа, К;
R – универсальная газовая постоянная 8,314 Дж/моль×K.
Если объём газа выражен в литрах, то уравнение Клапейрона-Менделеева записывается в виде:
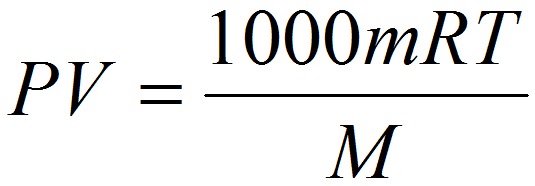
Из уравнения Клапейрона-Менделеева следует три закона:
1. Закон Шарля:
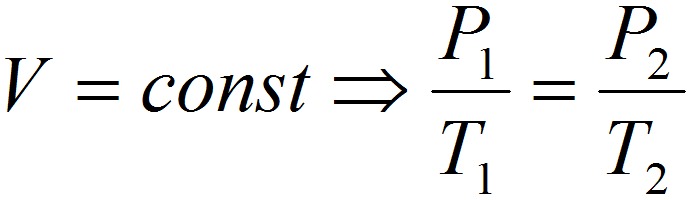
2. Закон Гей-Люссака:
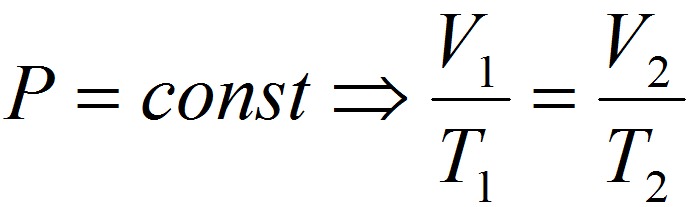
3. Закон Болйя-Мариотта:
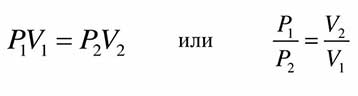
Все тесты
- Английский язык
- Биология
- История
- Физкультура
- Пушкин А.С
- Религия
- Карьера
- Информатика
- Физика
- Стихи
- Обществознание
- Сочинения
- ОБЖ
- Экономика
- Подготовка к ЕГЭ
- Помощь студенту
- География
- Математика
- Пунктуация
- Правоведение
- Орфография
- Анализ стихотворений
- Краткие содержания
- Биографии
- Литература
- Русский язык
- Окружающий мир
- Фонетический разбор
- Тест на тему To be going to: значение, правила употребления 5 вопросов
- Тест на тему Конструкция go on: значения, правила употребления, примеры 5 вопросов
- Тест на тему Be familiar with: значение и правила употребления 5 вопросов
- Тест на тему Британский vs американский английский: в чем разница? 5 вопросов
- Тест на тему Be mad about - как переводится и как использовать в речи 5 вопросов
- Тест на тему Be hooked on в английском языке: значение и примеры предложений 5 вопросов
- Тест на тему «To be made» в английском языке: значение, правила и примеры для школьников 5 вопросов
- Тест на тему Приставки in-, im-, il-, ir- в английском языке: полный разбор для школьников 5 вопросов
- Тест на тему «To be given» в английском языке: значение, употребление и примеры для школьников 5 вопросов
- Тест на тему Подборка интересных фактов про английский язык 5 вопросов
- Тест на тему История сибирской язвы и как она стала оружием 5 вопросов
- Тест на тему Что такое “железное легкое” и как жилось узникам аппарата 5 вопросов
- Тест на тему Суть и методы клеточной инженерии 5 вопросов
- Тест на тему Злаковые растения - общая характеристика, признаки и список представителей 7 вопросов
- Тест на тему Семейство бобовые - общая характеристика, строение и представители 7 вопросов
- Тест на тему Команда реформ: сподвижники Петра I 10 вопросов
- Тест на тему Экономика и управление: реформы Афанасия Ордина-Нащокина 10 вопросов
- Тест на тему Положение крестьян и указ Павла I о трехдневной барщине 10 вопросов
- Тест на тему Программа Южного общества и декабрист П. И. Пестель 10 вопросов
- Тест на тему Комитет общественного блага или Негласный комитет 10 вопросов
- Тест на тему Планы переустройства России: «Конституция» Муравьева 10 вопросов
- Тест на тему Характеристика «золотого века» российского дворянства 10 вопросов
- Тест на тему Содержание греческого проекта императрицы Екатерины II 10 вопросов
- Тест на тему Причины и ход денежной реформы Е. Ф. Канкрина 10 вопросов
- Тест на тему Как работал дворянский заемный банк 10 вопросов
- Тест на тему История и судьба владельческих крестьян 10 вопросов
- Тест на тему История битвы при Добрыничах 1605 года 10 вопросов
- Тест на тему 10 сталинских ударов: как Красная армия освободила Европу в 1944 году 10 вопросов
- Тест на тему Красный и белый террор в годы Гражданской войны 5 вопросов
- Тест на тему История появления имущественного неравенства и знати 5 вопросов
- Тест на тему Народы, населявшие Россию во второй половине 16 века 5 вопросов
- Тест на тему Первые государства: история образования и функции 5 вопросов
- Тест на тему Роль огня в жизни первобытных и современных людей 5 вопросов
- Тест на тему 5 самых известных разведчиков в истории 5 вопросов
- Тест на тему Присоединение к Московскому государству Смоленска 5 вопросов
- Тест на тему Причины и предпосылки объединения русских земель вокруг Москвы 5 вопросов
- Тест на тему Формирование русского централизованного государства 5 вопросов
- Тест на тему Краткая история Руси в 15 веке: главные события, культура 5 вопросов
- Тест на тему Причины и итоги установления автокефалии Русской Церкви 5 вопросов
- Тест на тему Особенности общественного строя и церковной организации на Руси 5 вопросов
- Тест на тему Когда появились первые известия о русских и Руси? 5 вопросов
- Тест на тему Призвание на княжение в Новгород варягов 5 вопросов
- Тест на тему История присоединения Псковского княжества к Московскому 5 вопросов
- Тест на тему История битв при Чашниках в 1564 и 1657 годах 5 вопросов
- Тест на тему Правление Василия 1 Дмитриевича 5 вопросов
- Тест на тему Земская реформа Ивана Грозного 5 вопросов
- Тест на тему Все князья Московского княжества 5 вопросов
- Тест на тему Причины, ход восстания Тадеуша Костюшко и его итоги 5 вопросов
- Тест на тему Последствия Смутного времени в России 5 вопросов
- Тест на тему Главные реформы короля Священной Римской империи Иосифа 2 5 вопросов
- Тест на тему Состав и функции государева двора 5 вопросов
- Тест на тему Суть “дела Дрейфуса” и реакция общества 5 вопросов
- Тест на тему Деятельность партии монтаньяров во Франции 5 вопросов
- Тест на тему Традиции и обычаи украинского народа 5 вопросов
- Тест на тему Причины закрытия Японии в 17 веке и последствия 5 вопросов
- Тест на тему Подготовка и содержание генерального плана “Ост” 5 вопросов
- Тест на тему Тайны убийства Петра Столыпина 5 вопросов
- Тест на тему Отмена подушной подати на Руси 5 вопросов
- Тест на тему Период регентства Елены Глинской: события и реформы 5 вопросов
- Тест на тему Экономика России в годы Первой мировой войны 5 вопросов
- Тест на тему Битва при деревне Лесной 28 сентября 1708 года 5 вопросов
- Тест на тему 10 любопытных фактов про Рождество 5 вопросов
- Тест на тему 10 любопытных фактов про Новый год 5 вопросов
- Тест на тему История потешных полков Петра Первого 5 вопросов
- Тест на тему Образование и распад тушинского лагеря при Лжедмитрии II 5 вопросов
- Тест на тему Реферат по физкультуре на тему: «Здоровое питание» 5 вопросов
- Тест на тему История развития лыжного спорта в разных странах - классификация и интересные факты 6 вопросов
- Тест на тему Важность самоконтроля при занятиях спортом 5 вопросов
- Тест на тему Как выполняются прыжки через козла? 5 вопросов
- Тест на тему Что такое здоровый образ жизни? 5 вопросов
- Тест на тему Как правильно выполнять кувырки? 5 вопросов
- Тест на тему Развитие гибкости тела: упражнения и польза для тела 5 вопросов
- Тест на тему Виды и польза прыжков через скакалку 5 вопросов
- Тест на тему Какие есть зимние виды спорта? 5 вопросов
- Тест на тему Реферат на тему: “Гимнастика как вид спорта” 8 вопросов
- Тест на тему Реферат по физкультуре на тему “Футбол” 7 вопросов
- Тест на тему Реферат по физкультуре на тему: “Баскетбол - виды и лиги” 7 вопросов
- Тест на тему Реферат на тему «Лыжный спорт» 10 вопросов
- Тест на тему Реферат по физической культуре «Формы и виды закаливания» 10 вопросов
- Тест на тему Образ Шарикова в повести «Собачье сердце» М. Булгакова 5 вопросов
- Тест на тему Образы героев в повести «Невский проспект» Н. Гоголя 5 вопросов
- Тест на тему Московские главы в романе «Мастер и Маргарита» Булгакова 7 вопросов
- Тест на тему Описание образа бирюка из рассказа И. Тургенева 7 вопросов
- Тест на тему Образы героев в романе «Отцы и дети» И. Тургенева 7 вопросов
- Тест на тему Образы героев в повести «Котлован» А. Платонова 7 вопросов
- Тест на тему Образы героев в пьесе «Гроза» А. Островского 7 вопросов
- Тест на тему История создания повести Н. В. Гоголя “Шинель” 7 вопросов
- Тест на тему История создания сборника рассказов Тургенева “Записки охотника” 7 вопросов
- Тест на тему История создания повести "Муму" Ивана Тургенева 7 вопросов
- Тест на тему История создания стихотворения "Реквием" Анны Ахматовой 10 вопросов
- Тест на тему История создания повести Гоголя "Тарас Бульба" 10 вопросов
- Тест на тему История создания стихотворения Пушкина "Деревня" 6 вопросов
- Тест на тему История создания стихотворения М. Лермонтова “Нищий” 7 вопросов
- Тест на тему История создания стихотворения "Она сидела на полу" 7 вопросов
- Тест на тему История создания Пушкиным стихотворения "К морю" 6 вопросов
- Тест на тему История создания повести «Станционный смотритель» А. Пушкина 10 вопросов
- Тест на тему История создания «Оды на день восшествия» М. Ломоносова 7 вопросов
- Тест на тему Что нужно сдавать на бухгалтера? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на пилота 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на фотографа? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на хореографа? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на актера? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на режиссера? 5 вопросов
- Тест на тему Что нужно сдавать на художника? 5 вопросов
- Тест на тему Что нужно сдавать для поступления на визажиста? 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на полицейского? 5 вопросов
- Тест на тему Какие предметы нужно сдавать на фармацевта? 5 вопросов
- Тест на тему Какие предметы сдавать для поступления на врача? 5 вопросов
- Тест на тему Какие экзамены нужно сдавать на учителя 5 вопросов
- Тест на тему Кадетский корпус - как поступить, чему учат и условия для проживания 5 вопросов
- Тест на тему Готовы ли вы к поступлению на психолога? 5 вопросов
- Тест на тему Готовы ли вы к поступлению на дизайнера? 5 вопросов
- Тест на тему Острова и полуострова Зарубежной Европы 10 вопросов
- Тест на тему Уровень урбанизации Африки: города растут, вызовы множатся 5 вопросов
- Тест на тему Уровень и особенности урбанизации Канады 5 вопросов
- Тест на тему Как найти полярную звезду и зачем ее искать? 5 вопросов
- Тест на тему Что нужно знать про контурные карты 5 вопросов
- Тест на тему Кто, когда и как открыл Австралию? 5 вопросов
- Тест на тему Характеристика природных зон Поволжья 5 вопросов
- Тест на тему Для каких рек в России характерно летнее половодье? 5 вопросов
- Тест на тему Как правильно заполнять дневник наблюдения за погодой 5 вопросов
- Тест на тему Влажные экваториальные леса - особенности климата, характеристика флоры и фауны 7 вопросов
- Тест на тему Европейский север России - географическое положение, особенности развития предприятий и промышленности 7 вопросов
- Тест на тему Что такое масштаб карты и как его определять 7 вопросов
- Тест на тему Особенности и примеры островных государств 5 вопросов
- Тест на тему Природные зоны Южной Америки - характеристики и особенности 7 вопросов
- Тест на тему 10 интересных фактов про океан 7 вопросов
- Тест на тему Сектор Газа: где он находится и откуда такое название? 6 вопросов
- Тест на тему Особенности раздельного написания местоимений с предлогами 5 вопросов
- Тест на тему Правописание падежных окончаний прилагательных 5 вопросов
- Тест на тему Правописание слов с непроверяемой безударной гласной в корне 5 вопросов
- Тест на тему Нужно ли ставить запятую к фразе - "с уважением"? 5 вопросов
- Тест на тему «Во-вторых» или «во вторых» – как правильно пишется? 5 вопросов
- Тест на тему "Нету" или "нет" - как правильно писать и говорить? 5 вопросов
- Тест на тему «Не я» или «нея» – как правильно пишется? 5 вопросов
- Тест на тему «Полным-полно» или «полным полно» - как правильно пишется? 5 вопросов
- Тест на тему Как пишется «кто-нибудь» или «кто нибудь»? 5 вопросов
- Тест на тему Мягкий знак после шипящих в глаголах - правила, примеры 5 вопросов
- Тест на тему «Потвёрже» или «по твёрже» – как правильно пишется? 5 вопросов
- Тест на тему «Какой-то» или «какой то» – как пишется правильно? 5 вопросов
- Тест на тему «Мало-помалу» или «мало помалу» – как правильно пишется? 5 вопросов
- Тест на тему «По-осеннему» или «по осеннему» – как правильно пишется? 5 вопросов
- Тест на тему "Находу" или "на ходу" - слитно или раздельно писать? 5 вопросов
- Тест на тему "ЮлИчка" или "ЮлЕчка" - как правильно писать? 5 вопросов
- Тест на тему «Не пойму» или «непойму» – как правильно пишется? 5 вопросов
- Тест на тему «Доброе утро» − как правильно пишется? 5 вопросов
- Тест на тему «Почему-то» или «почему то» – как правильно пишется? 5 вопросов
- Тест на тему «На вынос» или «навынос» – как правильно пишется? 5 вопросов
- Тест на тему «Невежливо» или «не вежливо» – как правильно пишется? 5 вопросов
- Тест на тему «Негодуя» или «не годуя» - как правильно пишется? 5 вопросов
- Тест на тему «КуриНый» или «куриННый» − как правильно пишется? 5 вопросов
- Тест на тему «ТеННис» или «теНис» – как правильно пишется? 5 вопросов
- Тест на тему «ТумаННый» или «тумаНый» – как правильно пишется? 5 вопросов
- Тест на тему «ЗамечеННый» или «замечеНый» – как правильно пишется? 5 вопросов
- Тест на тему «Семнадцать» или «семЬнадцать» – как правильно пишется? 5 вопросов
- Тест на тему «ВыздОравливающий» или «выздАравливающий» – как правильно пишется? 5 вопросов
- Тест на тему «Свеж» или «свежЬ» – как правильно пишется? 5 вопросов
- Тест на тему «СлаЩе» или «слаДЧе» – как правильно пишется? 5 вопросов
- Тест на тему «ПрЕтерпевать» или «прИтерпевать» - как правильно пишется? 5 вопросов
- Тест на тему «Удастся» или «удастЬся» – как правильно пишется? 5 вопросов
- Тест на тему «СписаНо» или «СписаННо» – как правильно пишется? 5 вопросов
- Тест на тему «Происшествие» или «проишествие» – как правильно пишется? 5 вопросов
- Тест на тему «НачИнающий» или «начЕнающий» – как правильно пишется? 5 вопросов
- Тест на тему «Невозможно» или «не возможно» – как пишется слитно или раздельно? 5 вопросов
- Тест на тему «Налету» или «на лету» – как правильно пишется? 5 вопросов
- Тест на тему «Надолго» или «на долго» – как правильно пишется? 5 вопросов
- Тест на тему «ПьющАя» или «пьющЕя» – как правильно пишется? 5 вопросов
- Тест на тему «Неужели» или «не ужели» − как правильно пишется? 5 вопросов
- Тест на тему «НИкого» или «нЕкого» – как правильно пишется? 5 вопросов
- Тест на тему «БаССейн» или «баСейн» − как правильно пишется? 5 вопросов
- Тест на тему "Не согласованно" или "несогласованно" - слитно или раздельно? 5 вопросов
- Тест на тему «ОбстОятельствам» или «обстАятельствам» – как правильно пишется? 5 вопросов
- Тест на тему «ОбижеННый» или «обижеНый» – как правильно пишется? 5 вопросов
- Тест на тему «Аллах» или «Алах» – как правильно пишется? 5 вопросов
- Тест на тему «БелОрусский» или «белАрусский» – как правильно пишется? 5 вопросов
- Тест на тему «ЧИсло» или «чЕсло» – как правильно пишется? 5 вопросов
- Тест на тему «УвЕряющий» или «увИряющий» – как правильно пишется? 5 вопросов
- Тест на тему «НенасТный» или «ненасный» – как правильно пишется? 5 вопросов
- Тест на тему Анализ стихотворения “Каким бы малым ни был...” К. Кулиева 5 вопросов
- Тест на тему Анализ стихотворения «Цицерон» Ф. Тютчева 5 вопросов
- Тест на тему Анализ стихотворения “Поэт” М. Лермонтова 5 вопросов
- Тест на тему Анализ стихотворения “Пора, мой друг, пора” А. Пушкина 5 вопросов
- Тест на тему Анализ стихотворения «Шестое чувство» Н. Гумилева 5 вопросов
- Тест на тему Анализ стихотворения “Юбилейное” В. Маяковского 5 вопросов
- Тест на тему Анализ стихотворения “Мой гений” К. Батюшкова 5 вопросов
- Тест на тему Анализ стихотворения «Нет, не тебя так пылко» М. Лермонтова 5 вопросов
- Тест на тему Анализ стихотворения «Догорел апрельский светлый вечер…» И. Бунина 5 вопросов
- Тест на тему Анализ стихотворения «Фонтан» Ф. Тютчева 5 вопросов
- Тест на тему Анализ стихотворения «Посмотри - какая мгла» Я. Полонского 5 вопросов
- Тест на тему Анализ стихотворения «Школьник» Н. Некрасова 5 вопросов
- Тест на тему Анализ стихотворения «Несжатая полоса» Н. Некрасова 5 вопросов
- Тест на тему «Весенний дождь» - анализ стихотворения А.А. Фета 7 вопросов
- Тест на тему «Поет зима - аукает» - анализ стихотворения С.А. Есенина 7 вопросов
- Тест на тему Краткое содержание повести «А тем временем где-то» А. Алексина 5 вопросов
- Тест на тему Краткое содержание комедии «Мнимый больной» Жана-Батиста Мольера 5 вопросов
- Тест на тему Краткое содержание комедии “Доходное место” А. Островского 5 вопросов
- Тест на тему Краткое содержание новеллы “Падение дома Ашеров” Эдгара По 5 вопросов
- Тест на тему Краткое содержание рассказа “Крепкий мужик” В. Шукшина 5 вопросов
- Тест на тему Краткое содержание пьесы «Золотая карета» Л. Леонова 5 вопросов
- Тест на тему Краткое содержание рассказа «Когда в доме одиноко» К. Саймака 5 вопросов
- Тест на тему Краткое содержание рассказа “Простите нас” Ю. Бондарева 5 вопросов
- Тест на тему Краткое содержание романа “Кысь” Т. Толстой 5 вопросов
- Тест на тему Краткое содержание повести “Это мы, Господи!” К. Воробьева 5 вопросов
- Тест на тему Краткое содержание романа «Как закалялась сталь» Н. Островского 5 вопросов
- Тест на тему Краткое содержание романа-эпопеи «Хождение по мукам» А. Толстого 5 вопросов
- Тест на тему Краткое содержание сказки “Журавль и цапля” 5 вопросов
- Тест на тему Краткий пересказ “О чем говорят цветы” Жорж Санд 5 вопросов
- Тест на тему Краткое содержание рассказа “Тринадцать лет” С. Баруздина 5 вопросов
- Тест на тему Краткое содержание рассказа «Парадокс» В. Короленко 5 вопросов
- Тест на тему Краткое содержание романа «Живые и мертвые» К. Симонова 5 вопросов
- Тест на тему Краткое содержание повести «Обмен» Юрия Трифонова 5 вопросов
- Тест на тему Краткое содержание рассказа “Алешкино сердце” М. Шолохова 5 вопросов
- Тест на тему Краткое содержание рассказа “Как я стал писателем” И. Шмелева 5 вопросов
- Тест на тему Краткое содержание рассказа “Гамбринус” А. Куприна 5 вопросов
- Тест на тему Краткое содержание сказки “Вафельное сердце” Марии Парр 5 вопросов
- Тест на тему Краткое содержание рассказа “Специалист” А. Аверченко 5 вопросов
- Тест на тему Краткое содержание пьесы «Трамвай “Желание”» Т. Уильямса 5 вопросов
- Тест на тему Краткое содержание романа “Война миров” Г. Уэллса 5 вопросов
- Тест на тему Краткое содержание рассказа “Баргамот и Гараська” Л. Андреева 5 вопросов
- Тест на тему Краткое содержание повести “Скотный двор” Д. Оруэлла 5 вопросов
- Тест на тему «Акула» Л. Толстого - краткое содержание 5 вопросов
- Тест на тему Русская народная сказка «Хвосты» - краткое содержание 5 вопросов
- Тест на тему Краткое содержание оперы «Снегурочка» Римского-Корсакова 5 вопросов
- Тест на тему «Обезьяний язык» М. Зощенко – краткое содержание 10 вопросов
- Тест на тему «Сердце не камень» - краткое содержание пьесы А.Н. Островского 5 вопросов
- Тест на тему Балет «Щелкунчик» — краткое содержание 7 вопросов
- Тест на тему Биография Владимира Вольфовича Жириновского 5 вопросов
- Тест на тему Биография поэта и писателя Льва Рубинштейна 5 вопросов
- Тест на тему Биография президента Белоруссии Александра Лукашенко 5 вопросов
- Тест на тему 10 интересных фактов про Афанасия Фета 5 вопросов
- Тест на тему 10 интересных фактов про Ивана Тургенева 5 вопросов
- Тест на тему Биография писателя и поэта Вячеслава Урюпина 5 вопросов
- Тест на тему Биография поэта Николая Михайловича Рубцова 5 вопросов
- Тест на тему Биография поэта Андрея Дмитриевича Дементьева 5 вопросов
- Тест на тему Биография президента РФ Владимира Путина 5 вопросов
- Тест на тему Биография и личная жизнь Даниила Хармса 5 вопросов
- Тест на тему Краткая биография Валентины Осеевой 5 вопросов
- Тест на тему Григорий Остер: биография писателя и избранные произведения 7 вопросов
- Тест на тему Елена Благинина: творческая биография и личная жизнь 10 вопросов
- Тест на тему Биография детской писательницы Ирины Пивоваровой 5 вопросов
- Тест на тему История создания рассказа «Матренин двор» А. Солженицына 5 вопросов
- Тест на тему История создания песни «Смуглянка» 5 вопросов
- Тест на тему История создания поэмы “Кому на Руси жить хорошо” Н. Некрасова 5 вопросов
- Тест на тему История создания романа “Как закалялась сталь” Н. Островского 5 вопросов
- Тест на тему История создания оперы М. Глинки «Иван Сусанин» 5 вопросов
- Тест на тему История создания знаменитой песни “Катюша” 5 вопросов
- Тест на тему История создания поэмы “За далью - даль” А. Твардовского 5 вопросов
- Тест на тему История создания стихотворения “Смерть поэта” М. Лермонтова 5 вопросов
- Тест на тему История создания рассказа “Кавказский пленник” Л. Н. Толстого 5 вопросов
- Тест на тему История создания песни Р. Гамзатова “Журавли” 5 вопросов
- Тест на тему История создания стихотворения “Зимнее утро” А. С. Пушкина 5 вопросов
- Тест на тему История создания рассказа "Судьба человека" М. Шолохова 5 вопросов
- Тест на тему История создания стихотворения "На холмах Грузии лежит ночная мгла..." А. Пушкина 5 вопросов
- Тест на тему История создания романа “Идиот” Ф. М. Достоевского 5 вопросов
- Тест на тему История создания рассказа «Васюткино озеро» В. Астафьева 5 вопросов
- Тест на тему История создания повести “Детство” Л. Толстого 5 вопросов
- Тест на тему История создания романа «Дон Кихот» М. Сервантеса 5 вопросов
- Тест на тему История создания романа «Бесы» Ф. Достоевского 5 вопросов
- Тест на тему История создания романа «Молодая гвардия» А. Фадеева 5 вопросов
- Тест на тему История создания пьесы «Моцарт и Сальери» А. С. Пушкина 5 вопросов
- Тест на тему История создания баллады «Лесной царь» Ф. Шуберта 5 вопросов
- Тест на тему "Миссия русской эмиграции" И. Бунина 5 вопросов
- Тест на тему История создания пьесы «Бесприданниц» А. Островского 5 вопросов
- Тест на тему История создания повести “Алые паруса” А. Грина 1 вопрос
- Тест на тему История создания романа “Бедные люди” Ф. Достоевского 5 вопросов
- Тест на тему Герои романа “Властелин колец” Д. Толкина 5 вопросов
- Тест на тему Анализ сказа “Серебряное копытце” П. Бажова 5 вопросов
- Тест на тему Характеристика Дуняши в романе “Тихий Дон” М. Шолохова 5 вопросов
- Тест на тему Описание образа Фамусова - персонажа комедии “Горе от ума” 5 вопросов
- Тест на тему Характеристика образа Сатина - персонажа пьесы “На дне” М. Горького 5 вопросов
- Тест на тему Анализ повести “Сашка” В. Кондратьева 5 вопросов
- Тест на тему Характеристика образа Фауста из трагедии Гёте 9 вопросов
- Тест на тему Анализ романа “Портрет Дориана Грея” О. Уайльда 5 вопросов
- Тест на тему Характеристика колобка - героя русской народной сказки 5 вопросов
- Тест на тему Образ главной героини “Алисы в стране чудес” Л. Кэррола 5 вопросов
- Тест на тему Трактовки образа Иисуса Христа в поэме “Двенадцать” А. Блока 5 вопросов
- Тест на тему Образ Настеньки из повести “Белые ночи” Ф. Достоевского 5 вопросов
- Тест на тему Конфликт в рассказе “После бала” Л. Толстого 5 вопросов
- Тест на тему Образ главной героини повести “Бедная Лиза” Н. Карамзина 5 вопросов
- Тест на тему Описание образа Васютки из рассказа “Васюткино озеро” В. Астафьева 5 вопросов
- Тест на тему Образы чиновников в комедии “Ревизор” Н. Гоголя 5 вопросов
- Тест на тему Роль образа вишневого сада в пьесе А. Чехова 5 вопросов
- Тест на тему Характеристика профессора Преображенского в повести “Собачье сердце” М. Булгакова 5 вопросов
- Тест на тему Описание образа городничего в комедии “Ревизор” Н. Гоголя 5 вопросов
- Тест на тему Описание образа главного героя “Доктора Живаго” Б. Пастернака 5 вопросов
- Тест на тему Образ Цыганка в повести “Детство” М. Горького 5 вопросов
- Тест на тему Характеристика Вани Солнцева в повести “Сын полка” В. Катаева 5 вопросов
- Тест на тему Образ автора в поэме "Василий Теркин" А. Твардовского 5 вопросов
- Тест на тему Образ портрета в повести "Портрет" Н. В. Гоголя 5 вопросов
- Тест на тему Описание образа девушки-ундины из “Героя нашего времени” М. Лермонтова 5 вопросов
- Тест на тему Как выполнить разбор наречия по составу 5 вопросов
- Тест на тему Правила правописания суффиксов наречий 5 вопросов
- Тест на тему Морфологический признак наречий: неизменяемость 5 вопросов
- Тест на тему Чем отличаются и как найти тему и рему в тексте? 5 вопросов
- Тест на тему Способы и примеры образования наречий 5 вопросов
- Тест на тему Особенности и применение составных предлогов 5 вопросов
- Тест на тему Какую синтаксическую роль в предложении выполняет наречие 5 вопросов
- Тест на тему Какие признаки прилагательного есть у причастия 5 вопросов
- Тест на тему Морфологический разбор союзов: инструкция, примеры 5 вопросов
- Тест на тему Морфологические признаки действительных и страдательных причастий 5 вопросов
- Тест на тему Особенности и примеры звукоподражательных слов 5 вопросов
- Тест на тему Какие бывают и как определить смысловую группу наречий 5 вопросов
- Тест на тему Неправильное построение предложений с косвенной речью: примеры ошибок 5 вопросов
- Тест на тему Расстановка знаков препинания в сложноподчиненных предложениях 5 вопросов
- Тест на тему Виды синтаксических связей в словосочетаниях и предложениях 5 вопросов
- Тест на тему Оформление и примеры несобственно-прямой речи в тексте 5 вопросов
- Тест на тему Структура текста с параллельной связью предложений 5 вопросов
- Тест на тему Литературный язык: понятие, признаки, формы 5 вопросов
- Тест на тему Функции и роль языка в жизни человека и общества 5 вопросов
- Тест на тему Сообщение на тему: «Традиции русской речевой манеры общения» 5 вопросов
- Тест на тему Определение и виды простых осложненных предложений 5 вопросов
- Тест на тему Какие бывают виды текстов? 5 вопросов
- Тест на тему Образование и правописание страдательных причастий настоящего времени 5 вопросов
- Тест на тему Как определить начальную форму прилагательного? 5 вопросов
- Тест на тему Местоимение-прилагательное в русском языке 5 вопросов
- Тест на тему Сборник правил по русскому языку для 6 класса 7 вопросов
- Тест на тему Сборник правил по русскому языку за 5 класс 7 вопросов
- Тест на тему Упражнения для тренировки школьников 7 класса по причастному обороту 9 вопросов
- Тест на тему Тест: Склонение фамилий в русском языке 7 вопросов
- Тест на тему Общеупотребительные и необщеупотребительные слова 5 вопросов
- Тест на тему Дефисное и слитное написание сложных прилагательных 5 вопросов
- Тест на тему Морфологический разбор числительного - правило и примеры 5 вопросов
- Тест на тему Урало-сибирская роспись: истоки, техника, развитие 10 вопросов
- Тест на тему История палехской росписи: зарождение, мастера и художественный стиль 10 вопросов
- Тест на тему История мезенской росписи: происхождение, развитие и символика 10 вопросов
- Тест на тему История жостовской росписи: происхождение, развитие и канон 10 вопросов
- Тест на тему Проект на тему: “Экономика родного края: Самарская область” 5 вопросов
- Тест на тему Как люди узнают о том, что было в прошлом? 5 вопросов
- Тест на тему Какие животные впадают в спячку зимой: объяснения зоологов 7 вопросов
- Тест на тему Сообщение по окружающему миру для 4 класса об острове Врангеля 5 вопросов
- Тест на тему Сообщение о морских обитателях - описание, виды и названия 7 вопросов
- Тест на тему "Банты" - как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Конечно же» - выделяется ли слово запятыми? 5 вопросов
- Тест на тему «Подчеркивать» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Лифты» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Строку» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Апостроф» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Зубчатый» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Прозорлива» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Балашиха» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Реку» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Полно» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Говорено» – как правильно ставить ударение в слове? 5 вопросов
- Тест на тему «Досыта» – как правильно ставить ударение в слове? 5 вопросов